Ново изследване носи нова надежда за ново лечение за пациенти с глиобластом, след като идентифицира начин да спре растежа на този животозастрашаващ мозъчен тумор.
Учените от Масачузетския технологичен институт (МИТ) в Бостън са идентифицирали механизма, чрез който специфичен протеин, наречен PRMT5, стимулира растежа на глиобластомните тумори.
Нещо повече, блокирайки този механизъм с клас от съществуващи лекарства, те успяват да арестуват растежа на глиобластомния тумор при мишки.
Лидерът на изследването Кристиан Браун, който е бил следдипломен студент в МИТ по време на изследването, и неотдавна колегите му публикуват своите констатации в списанието.
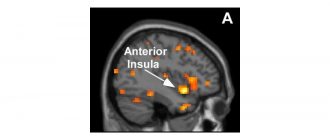
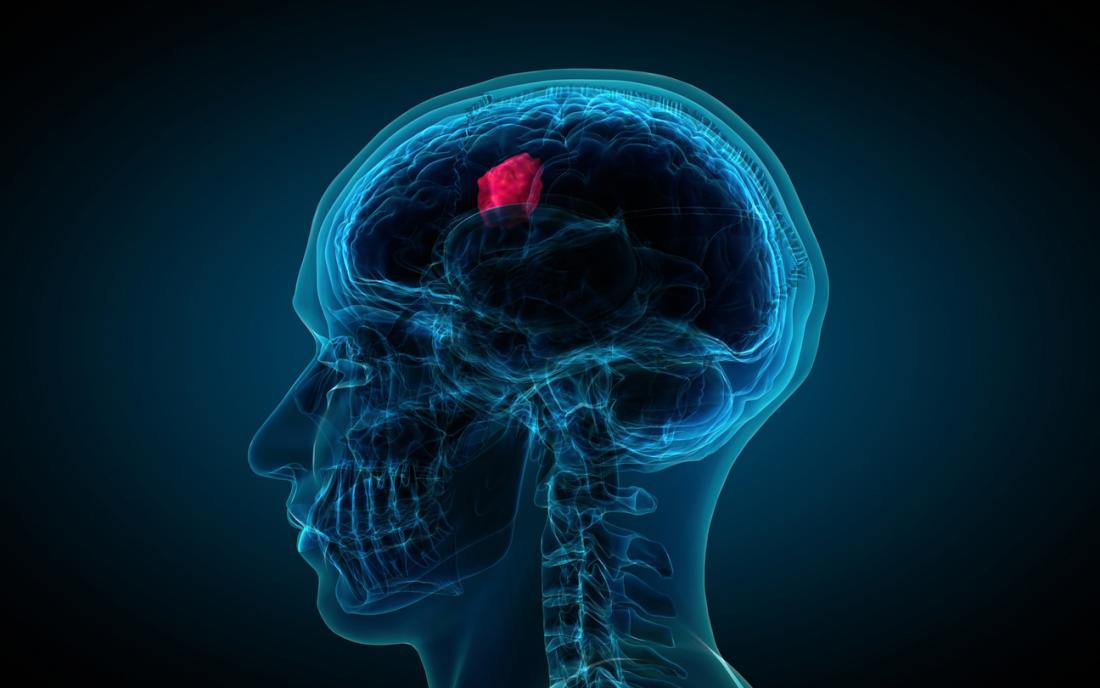
Глиобластом – също така наричан мултиформен глиобластом – е вид злокачествен мозъчен тумор, който се образува от звездообразни глиални клетки, наречени астроцити.
Според Американската асоциация за тумори на мозъка, през тази година се очаква да бъдат диагностицирани почти 80 000 нови случая на първични мозъчни тумори в Съединените щати. От тях glioblastoma ще представлява около 14,9%.
Въпреки че глиобластомите не са най-честият мозъчен тумор, те са най-смъртоносните; средната преживяемост е едва 14,6 месеца след диагнозата на глиобластома, ако пациентът е лекуван с химиотерапия и лъчетерапия.
Като такава, има отчаяна нужда да се идентифицират нови терапии за предотвратяване и лечение на глиобластома. Браун и колегите вярват, че резултатите от проучването им могат да помогнат за постигането на тази цел.
PRMT5 и генно снаждане
В предишни изследвания Браун и неговата колега Моника Станчи от Министерството на биологията в МИТ определиха PRMT5 като потенциален двигател на глиобластомните тумори, но точните механизми, с които протеинът го прави, не бяха ясни.
Изводите сочат, че PRMT5 може да участва в уникална форма на "генно снаждане", която подхранва растежа на глиобластомите.
Изследователите обясняват, че генното снаждане е процес, при който секции от messenger RNA (mRNA), наречени интрони, са "отрязани" от нишките на mRNA, тъй като те вече не са необходими, след като генетичната информация е предадена на тРНК.
По-късно изследването разкрива, че около един до три "задържани интрона" се задържат в около 10 до 15 процента от нишките на човешка тРНК и тези останали интрони пречат на молекулите на иРНК да напуснат клетъчното ядро.
"Това, което мислим, е, че тези направления са основно язовир на мРНК", казва Браун, който сега се намира в университета "Лудвиг Максимилиан" в Мюнхен в Германия. – Имате тези непродуктивни изоформи, разположени в ядрото, и единственото, което ги предпазва от превеждането им, е един интрон.
В своето последно проучване, както се предполага, изследователите установяват, че PRMT5 играе съществена роля в уникалния процес на генно снаждане; те показват, че мозъчните стволови клетки имат високи нива на PRMT5, които те използват, за да осигурят ефективно снаждане и по-голяма експресия на гени, свързани с клетъчната пролиферация или растежа и делението.
"Тъй като клетките се придвижват към зрялото си състояние, нивата на PRMT5 спадат, задържаните нива на интрон се покачват, а тези messenger RNAs, свързани с пролиферацията, се забиват в ядрото", обяснява съавторът на изследването Жаклин Лий от Института за интегративни методи на Дейвид Х. Кок Изследване на рака в МИТ.
Те обясняват, че в раковите мозъчни клетки нивата на PRMT5 се повишават отново, което от своя страна активира уникалния процес на генно снаждане и насърчава раковите клетки да излязат извън контрол.
Спиране на растежа на глиобластома при мишки
Изследователите допълнително потвърждават своите открития в човешките глиобластомни клетки. Когато инхибират PRMT5 – който предотвратява производството на PRMT5 протеин – в туморните клетки, те установяват, че клетъчният растеж и деленето са прекратени.
Изследователите също са в състояние да спрат растежа на глиобластомните тумори в моделите на мишки чрез лечение с PRMT5 инхибитори.
Коментирайки констатациите на екипа, Омар Абдел-Уахаб от "Мемориал Слоун Кетеринг" в Ню Йорк, който не участва в изследването, казва: "PRMT5 има много роли и досега не е ясно какво е пътят, който е наистина важен за приноса му за рак. "
"Това, което те откриха, е, че един от ключовите приноси е в този механизъм за снаждане на РНК, а освен това, когато сриването на РНК е нарушено, този ключ е деактивиран."
Освен това проучването идентифицира биомаркер, който според изследователите може да бъде използван за идентифициране на пациенти, които вероятно ще реагират добре на лечение с PRMT5 инхибитори.
Това проучване не само хвърля светлина върху основните причини за глиобластома, но и може да отвори вратата към нови стратегии за превенция и лечение на този смъртоносен рак.