Едно съединение, наречено кампинол, показва голямо обещание като бъдещо лекарство на Алцхаймер. Молекулата е спряла разпространението на токсичния мозъчен протеин тау в клетъчни култури и мишки.

Например, мозъчен протеин, наречен тау, играе ключова роля в развитието на болестта на Алцхаймер.
Нашите мозъчни клетки имат "транспортна система", направена от прави, паралелни "пътища", по които могат да пътуват хранителни молекули, хранителни вещества и изхвърлени части от клетки.
В здрав мозък протеинът tau помага на тези песни да останат права. Въпреки това, при болестта на Алцхаймер протеинът се натрупва до абнормни нива, образувайки вредни структури, наречени възли.
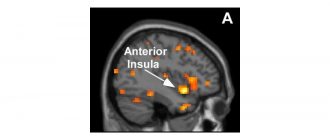
Първоначално тези заплитания се образуват в областите на мозъка, които са ключови за образуването на паметта, но когато болестта прогресира, заплитанията продължават да се разпространяват в останалата част от мозъка.
Въпреки това, изследователи от Калифорнийския университет в Лос Анджелис (UCLA) сега можеха да намерят начин да спрат разпространението на тези вредни заплетени връзки.
Техното ново проучване – публикувано в списанието – показва как една малка молекула, наречена камбинол, спира татуировките от мигриране от клетка към клетка.
Изследователят, водещ изследването Varghese John, доцент по неврология в UCLA, коментира значението на констатациите, като казва: "Повече от 200 молекули са тествани като болест-модифицираща терапия на Алцхаймер по време на клинични проучвания и никой все още не е достигнал свещения граал. "
"Нашата статия описва нов подход за забавяне на прогресията на Алцхаймер, като показва, че е възможно да се възпрепятства разпространението на патологичните форми на тау."
Варжис Джон
Cambinol блокира тау трансфера
В здрав мозък тау протеинът гарантира, че пистите остават прави, като се свързват с микротубулите, които образуват скелета на клетките.
Но в болестта на Алцхаймер, тау се отделя и "пада" от скелета, като вместо това създава така наречените неврофибрилни заплитания, което причинява смъртта на мозъчните клетки.
Ситуацията се влошава, когато тези мозъчни клетки продължават да обграждат тау бучки или агрегати в малки джобове, които след това мигрират и "установяват" в околните здрави тъкани.
Тези малки липидни джобове или везикули се наричат екзозоми. Те осигуряват непрекъснатото разпространение на тау ъглите. Но какво би станало, ако има начин да се блокира самото образуване на тези "торбички" за токсичния тау протеин?
Анализирайки поведението на тау протеина in vitro (в клетъчните култури) и in vivo (използвайки модели на мишки), изследователите установиха, че кампинолът има способността да прави точно това: той отвлича трансфера на тау чрез блокиране на ензим, наречен nSMase2, е от ключово значение за производството на тау-носещи ексозоми.
В един експеримент учените са използвали тау-носещи клетки, получени след смъртта от мозъка на хора, които са имали болестта на Алцхаймер. Те смесват тези клетки с клетки без тау.
Тау агрегатите продължават да се разпространяват в клетките, които не са третирани с камбинол. Но при тези, които са получили лечението, новите и здрави клетки не са били "замърсени" с тау.
Към новите лекарства на Алцхаймер
Изследователите смятат, че тези надеждни резултати се дължат на камбинол, който подтиска активността на ензима nSMase2 и че този механизъм може да осигури отлична основа за бъдещо разработване на лекарства.
Всъщност, при втори in vivo експеримент изследователите са видели, че активността на ензима е намалена в мозъците на мишки, лекувани с кампинол. Това беше особено обещаващо.
"Получаването на молекули в мозъка е голямо препятствие, защото повечето лекарства не проникват в кръвно-мозъчната бариера", обяснява Джон. "Сега знаем, че можем да лекуваме животни с кампинол, за да определим ефекта му върху патологията и прогресията на Алцхаймер".
До знанието на авторите това беше първото проучване, което показа, че кампинолът потиска активността на ензима nSMase2. Констатациите ни приближават до нови лечения за болестта на Алцхаймер, както и за други състояния, характеризиращи се с тау агрегати.
"Разбирането на пътищата е първата стъпка към въвеждането на нови лекарствени цели", казва съавторът на изследването Карън Гилис, професор по кърмене в UCLA.
"С кампинол в ръка, имаме полезен инструмент за разбиране на клетъчните пътища, които позволяват разпространението на патологията на тау."
Карън Гилис
В момента изследователите работят за проектиране на лекарства, които правят кампинол по-мощен, и се надяват, че тяхната работа ще се окаже успешна при животните.
Ако случаят е такъв, следващата стъпка ще бъде тестването на новите лекарства в клиничните проучвания при хора.