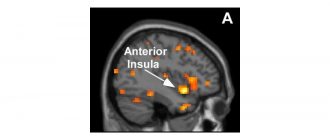
Нови изследвания разкриват цел за хронична и патологична болка, която може да доведе до по-добри лекарства за болните в бъдеще.
Хроничната болка е "най-честата причина за дългосрочна инвалидност", според Националните институти по здравеопазване (NIH).
Всъщност, според скорошен анализ на НИХ, повече от 25 милиона души в Съединените щати (или над 11% от възрастното население на страната) живеят с хронична болка. Това означава, че всеки ден през последните 3 месеца са боледували от болка.
Докато в някои случаи хроничната болка може да е била първоначално предизвикана от инцидент като нараняване или инфекция, през повечето време причината за хроничната болка не е известна.
Тъй като неговите причини остават до голяма степен неизвестни, хроничната болка все още не може да бъде излекувана. Въпреки това, наркотиците обикновено помагат и изследователите работят усилено, опитвайки се да излязат с по-ефективни лечения.
Сега ново проучване, публикувано в списанието, е идентифицирало потенциална нова терапевтична цел за хронична болка, която би могла да помогне на изследователите да разработят алтернативен медикамент за лечение на болка в близко бъдеще.
Екипът беше ръководен от д-р Матю Далва от Катедрата по неврология в университета "Томас Джеферсън" във Филаделфия, Пенсилвания. Той и екипът му са изследвали процес, наречен фосфорилиране и влиянието му върху това как се проявява хроничната болка и какви усещания предизвиква.
Фосфорилирането е термин, който описва общ биологичен процес, при който протеин се променя в отговор на външни стимули.
Идентифициране на нов рецептор на болка
Предишни изследвания са идентифицирали рецептор за болка, наречен N-метил-D-аспартат (NMDA) и факта, че той играе ключова роля в патологичната болка.
Този рецептор обаче също е важен в паметта и ученето, така че лекарствата, които биха насочили този рецептор, също ще повлияят на тези функции.
Но в новото проучване д-р Далва и колегите идентифицират втори рецептор, който също играе решаваща роля в болката. В проучването си учените изследвали по-специално невроните.
По-специално, чрез провеждане на серия от лабораторни тестове в клетъчни култури и in vivo екипът е успял да види, че в отговор на причинена от нараняване болка, протеинът ефрин В модифицира мозъчната клетка. Това фосфорилиране извън клетката позволява на ефрин В рецептора да се прикрепи към NMDA рецептора, като го премести в синапсите.
Този процес променя функцията на NMDA рецептора, което води до по-висока чувствителност към болка.
Както обясняват авторите, патологичната болка се различава от болката, причинена от увреждане или възпаление, защото е резултат от клетъчна дисфункция.
Тъй като на клетъчното ниво възниква болка, тя не изчезва дори и след като първоначалната причина е отишла – какъвто е случаят с хроничната болка или общата мигрена.
За да функционира правилно клетката, протеините трябва да са на правилното място. Но това, което показва новото изследване, е, че в случай на хронична болка, така нареченият процес на фосфорилиране "движи" протеините далеч от неврона, като по този начин предизвиква клетъчна дисфункция и патологична болка.
Важно е, че с помощта на модел на мишката учените също са в състояние да тестват някои химикали, които успяват да блокират нежеланото синергично действие между ефрин В рецептора и NMDA рецептора.
Прекъсването на тази комуникация между двата рецептора спря болката. И обратно, привеждането на двата рецептора заедно води до прекомерна чувствителност към болка.
Старшият автор на изследването коментира значението на констатациите, като казва: "Тъй като протеиновата модификация, която предизвиква нервната чувствителност към болката, се появява извън клетката, тя ни предлага по-лесна цел за разработване на лекарства. поле на управление на болката. "
"Въпреки че все още не сме открили точния механизъм, който причинява тази модификация […], тази находка предлага както цел за разработване на нови лечения, така и силен нов инструмент за изучаване на синапси като цяло".
Д-р Матю Далва