Клиничните проучвания са научни изследвания, чиято цел е да се определи дали медицинската стратегия, лечение или устройство са безопасни за употреба или консумация от хора.
Тези проучвания могат също така да оценят доколко е ефективен медицински подход за конкретни условия или групи от хора.
Като цяло, те добавят към медицинските знания и предоставят надеждни данни за подпомагане на вземането на решения в здравеопазването и насоките.
За да се гарантира безопасността на участниците, проучванията започват с малки групи и изследват дали нов метод причинява вреда или незадоволителни странични ефекти. Това е така, защото техника, която е успешна в лаборатория или при животни, може да не е безопасна или ефективна за хората.
Бързи факти за клиничните изпитвания
- Клиничните изпитвания имат за цел да установят дали медицинската стратегия, лечение или устройство са безопасни и ефективни за хората да използват или консумират.
- Проучванията се състоят от четири фази и могат да се съсредоточат върху: лечение, превенция, диагностика, скрининг, поддържаща грижа, изследване на здравни услуги и основна наука.
- Изследователският екип вероятно ще включва лекари, медицински сестри, социални работници, здравни специалисти, учени, ръководители на данни и координатори на клинични изпитания.
- Участието може да включва както рискове, така и ползи. Участниците трябва да прочетат и подпишат документа "информирано съгласие", преди да се присъединят към процеса.
- Рисковете се контролират и наблюдават, но естеството на изследванията в медицинските изследвания означава, че някои рискове са неизбежни.
Какви са клиничните изпитвания?
Основната цел на клиничните изпитвания е изследване. Проучванията са предназначени да добавят към медицинските познания, свързани с лечението, диагностицирането и профилактиката на заболявания или състояния.

Проучванията следва строги научни стандарти и насоки, които имат за цел:
- защита на участниците
- дават надеждни и точни резултати
Клиничните изпитвания върху хора се появяват в крайните етапи на дълъг, систематичен и задълбочен изследователски процес.
Процесът често започва в лаборатория, където се разработват и тестват нови концепции.
Тестването на животни дава възможност на учените да видят как подходът засяга живото тяло.
И накрая, човешкото тестване се извършва в малки и по-големи групи.
Проучванията могат да се провеждат за:
- Оценявайте една или повече терапевтични интервенции за заболяване, синдром или състояние, като лекарства, медицински изделия или подходи за хирургия или терапии
- Оценявайте начините за предотвратяване на заболяване или състояние, например чрез лекарства, ваксини и промени в начина на живот
- Оценявайте една или повече диагностични интервенции, които биха могли да идентифицират или диагностицират определена болест или състояние
- Проучете идентификационните методи за разпознаване на състояние или рискови фактори за това състояние
- Проучете процедурите за поддържаща грижа, за да подобрите комфорта и качеството на живот на хората с хронично заболяване
Резултатът от едно клинично проучване може да установи дали нова медицинска стратегия, лечение или устройство:
- има положителен ефект върху прогнозата на пациента
- причинява непредвидени вреди
- няма положителни ползи или има отрицателни ефекти
Клиничните изпитвания могат да предоставят ценна информация относно рентабилността на лечението, клиничната стойност на диагностичния тест и начина, по който лечението подобрява качеството на живот.
Видове клинично изпитване
Всички клинични изпитвания имат основна цел. Те могат да бъдат разделени на следните категории:
- Лечение: Тестване на нови лечения, нови лекарствени комбинации или нови подходи за хирургия или терапия
- Превенция: Разглеждане на начини за подобряване на превенцията или повторното възникване на заболявания, например чрез лекарства, витамини, ваксини, минерали и промени в начина на живот
- Диагностика: Намиране на подобрени техники за тестване и процедури за диагностициране на заболявания и състояния
- Проверка: Изследване на най-добрия метод за идентифициране на определени болести или здравни условия
- Поддържаща грижа: Проучване на процедури за подобряване на комфорта и качеството на живот на пациентите с хронично заболяване
- Изследвания в областта на здравните услуги: Оценка на доставката, процеса, управлението, организацията или финансирането на здравеопазването
- Основна наука: Изследване как работи интервенцията
Защо са важни клиничните изпитвания?
Клиничните изпитания спомагат за подобряване и ускоряване на медицинската помощ. Изследванията предоставят фактически доказателства, които могат да бъдат използвани за подобряване на грижите за пациентите.
Клиничните изследвания се провеждат само ако лекарите не знаят елементи като:
- дали новият подход работи ефективно при хората и е безопасен
- какви лечения или стратегии работят най-успешно за определени заболявания и групи индивиди
Как функционират клиничните изпитвания?
Различни елементи участват в създаването, функционирането и проследяването на клинично изпитване.
Протокол за клиничните изпитвания

Проучването следва цялостен план или протокол. Протокол е писменото описание на клинично изпитване.
Той включва целите, дизайна и методите на проучването, съответната научна подготовка и статистическата информация.
Основната информация, която трябва да включите, може да бъде:
- броя на участниците
- който отговаря на условията за участие
- какви тестове ще бъдат дадени и колко често
- видовете данни, които трябва да бъдат събрани
- продължителността на изследването
- подробна информация за плана за лечение
Избягване на пристрастия
Изследователите трябва да предприемат мерки за избягване на пристрастност.
Пристрастеността се отнася до избора на хора или други фактори, които не са свързани с протокола, но могат да повлияят на резултатите от изпитването.
Стъпките, които могат да помогнат за избягване на пристрастност, са групите за сравнение, рандомизирането и маскирането.
Сравнителни групи
Повечето клинични проучвания използват сравнителни групи за сравняване на медицинските стратегии и лечения. Резултатите ще покажат дали една група има по-добър резултат от другия.
Това обикновено се извършва по два начина:
- Една група получава съществуващо лечение за състояние и втората група получава ново лечение. След това изследователите сравняват коя група има по-добри резултати.
- Една група получава ново лечение и втората получава плацебо, неактивен продукт, който прилича на тествания продукт.
Произволна
Клиничните изпитвания със сравнителни групи често използват рандомизация. Участниците се разпределят на сравнителни групи по случайност, а не по избор. Това означава, че всички различия, наблюдавани по време на опита, ще се дължат на използваната стратегия, а не на съществуващите различия между участниците.
Маскиране или ослепяване
Маскирането или заслепяването помагат да се избегне пристрастност, като не се информират участниците или изследователите кое лечение ще получат участниците.
Единична сляпо: Точно когато участниците или изследователите не знаят, коя група е коя.
Двойно сляпо: Точно когато участниците и изследователите не знаят.
Замърсяващи фактори
Един объркан може да изкриви истинската връзка между две или повече характеристики.
Например, може да се заключи, че хората, които носят запалка, имат по-голяма вероятност да развият рак на белите дробове, тъй като носенето на запалка причинява рак на белите дробове. Пушенето е объркващо в този пример.
Хората, които носят запалка са по-склонни да бъдат пушачи, а пушачите са по-склонни да развият рак на белите дробове, но някои хора могат да носят запалка за други цели.
Ако не вземете това предвид, това може да доведе до неверни заключения.
Кой е в изследователския екип?
Основен изследовател, който обикновено е лекар, ще води всяко клинично проучване.
Изследователският екип може да включва:
- лекари
- медицински сестри
- социални работници
- Професионалисти в здравеопазването
- учени
- мениджъри на данни
- координатори на клинични изпитания
Къде се провеждат клиничните изпитвания?
Местоположението ще зависи от вида на обучението и кой го организира.
Някои често срещани местоположения включват:
- болници
- университетите
- медицински центрове
- лекарски кабинети
- обществени клиники
- федерално финансирани и финансирани от индустрията изследователски сайтове
Колко време издържат изпитанията?
Това зависи от това, което се проучва, наред с други фактори. Някои изпитания минали дни, докато други продължават от години.
Преди да се включат в процеса, участниците ще бъдат информирани колко дълго се очаква да продължи.
Проектиран и организиран
Има различни видове обучение и различни начини за тяхното организиране. Ето някои видове изследвания.
Наблюдавателни проучвания
Изследванията на кохортата и проучванията на случаите са примери за наблюдателни изследвания.
Кохортно проучване

Едно кохортно проучване е наблюдателно проучване, в което се избира изследваната популация или кохорта.
Събира се информация, за да се установи кои теми имат или:
- специфична характеристика, като кръвна група, за която се смята, че е свързана с развитието на въпросната болест
- излагане на фактор, който може да бъде свързан с болест, например пушене на цигари
Едно лице може да бъде избрано, защото пуши. След това те могат да бъдат проследени навреме, за да видят колко вероятно са те да развият заболяване в сравнение с други хора.
Този тип проучване се използва за проучване на ефекта от предполагаеми рискови фактори, които не могат да бъдат контролирани експериментално, като въздействието на тютюнопушенето върху рака на белия дроб.
Основните предимства на кохортните изследвания са:
- Излагането се измерва преди началото на заболяването и следователно е вероятно да бъде безпристрастно по отношение на развитието на болестта.
- Рядката експозиция може да бъде изследвана чрез подходяща селекция на кохортите от проучването.
- Многократни резултати – или заболявания – могат да бъдат изследвани за всяка една експозиция.
- Честотата на заболяването може да се изчисли както в експонираните, така и в неекспонираните групи.
Основните недостатъци на кохортните изследвания са:
- Те са склонни да бъдат скъпи и отнемат много време, особено ако се провеждат перспективно, което означава напредък.
- Промените в състоянието на експозиция и критериите за диагностика във времето могат да повлияят на класификацията на индивидите в зависимост от степента на експозиция и болест.
- В крайния резултат може да има отклонение от информацията, тъй като състоянието на експозицията на субекта е известно.
- Загубите за проследяване могат да представят отклонение при подбора.
Изследвания за контролиране на случаите
Проучването за случаи на контрол може да разграничи рисковите фактори за определено медицинско състояние.
Изследователите сравняват хората със състояние и тези без него. Работейки назад във времето, те определят как се различават двете групи.
Проучванията на контрола на случаите винаги са ретроспективни – гледащи назад – защото те започват с резултата и след това се проследяват, за да разследват експозициите.
Основните предимства на проучванията на случаите са:
- Резултатите могат да бъдат получени бързо.
- Проучването може да се проведе с минимално финансиране или спонсорство.
- Те са ефективни за изследване на редки заболявания или заболявания с продължителен индукционен период.
- Може да се изследва широк кръг от възможни рискови фактори.
- Възможно е да се изследват многократни експозиции.
- Те изискват малко учебни предмети.
Основните недостатъци на контролираните от случая изследвания са:
- Данните за честотата не могат да бъдат генерирани.
- Те са предмет на пристрастия.
- Може да е трудно да се получат точни, безпристрастни мерки от минали експозиции, ако воденето на записи е неадекватно или ненадеждно. Това се нарича "пристрастяване към информацията".
- Изборът на контролите може да е проблематичен. Това може да доведе до отклонение на селекцията.
- Хронологичната последователност между експозицията и болестта може да се окаже трудна за идентифициране.
- Те не са подходящи за изследване на редки експозиции, освен ако експозицията не е отговорна за голям процент от случаите.
Вложено проучване за случайно контролиране
В проучване за примерен контрол на случаите групите – случаи и контроли – идват от същата популация от проучвания или от кохортата.
Тъй като кохортата се проследява напред, случаите, които възникват, се превръщат в "случаи" в проучването на случаите. Неповлияните участници в кохортата стават "контролите".
Вложените проучвания за контролиране на случаите са по-евтини и по-малко време отнемат в сравнение с едно кохортно проучване.
Честотата на разпространение и разпространението на заболяването може понякога да се прогнозира от обединено изследване на кохортно изследване на случаите. Това не е възможно от обикновено проучване на контрола на случаите, тъй като общият брой на изложените индивиди и времето на проследяване обикновено не са известни.
Основните предимства на внедрените проучвания на случаите са:
- Ефективност: Не всички участници в кохортата изискват диагностични тестове.
- Гъвкавост: Те позволяват тестването на хипотези, които не са били предвидени, когато кохортата е планирана.
- Намаляване на пристрастността към селекцията: От една и съща популация се вземат проби и контроли.
- Намаляване на пристрастността към информацията: Експозицията на риска може да бъде оценена при положение, че изследователят е сляп в зависимост от случая.
Основният недостатък е, че резултатите имат по-нисък авторитет, поради малкия размер на извадката.
Екологично проучване
Екологичното проучване разглежда връзката между експозицията и изхода на населението или общността.
Общите категории на екологичното проучване включват:
- географски сравнения
- анализ на времевите тенденции
- проучвания на миграцията
Основните предимства на екологичните проучвания са:
- Те са евтини, тъй като рутинно събраните данни за здравето могат да бъдат използвани.
- Те отнемат по-малко време от други проучвания.
- Те са неусложнени и ясни за разбиране.
- Ефектът на експозициите, които се измерват върху групи или области – като диета, замърсяване на въздуха и температура – може да бъде изследван.
Основните недостатъци на екологичните проучвания са:
- Могат да възникнат грешки при приспадане, познати като екологична заблуда. Това се случва, когато изследователите правят изводи за индивидите въз основа единствено на анализа на груповите данни.
- Експозицията на изходните връзки е трудна за откриване.
- Липсва информация за объркващи фактори.
- Възможно е да има систематични разлики между отделните области по отношение на начина на измерване на експозицията.
Експериментални проучвания
Освен наблюдателни проучвания има и експериментални проучвания, включително проучвания на лечението.
Рандомизирани контролирани проучвания

Рандомизирано контролирано проучване (РСТ) разпределя на случаен принцип индивидите или за да получат или да не получат определена намеса.
Ще се използва едно от двете различни лечения, или лечение и плацебо.
Това е най-ефективният тип проучване за идентифициране на това кое лечение е най-добро. Той намалява влиянието на външните променливи.
Основните предимства на RCTs са:
- Няма съзнателно или подсъзнателно отклонение от страна на изследователя. Това по същество гарантира външна валидност.
- Заблуждаващите променливи като възраст, пол, тегло, ниво на активност и т.н. могат да бъдат отменени, стига пробната група да е достатъчно голяма.
Основните недостатъци на RCTs са:
- Те отнемат много време.
- Те могат да бъдат скъпи.
- Те изискват големи групи проби.
- Редките събития могат да бъдат трудни за изучаване.
- Възможни са фалшиви положителни и фалшиво-отрицателни статистически грешки.
Адаптивно клинично изпитване
Методът за адаптивен дизайн се основава на събраните данни. Тя е гъвкава и ефективна. Могат да се направят промени в опита и статистическите процедури на текущите клинични изпитвания.
Квази-експеримент
Квази-експерименталните или "нерадоризирани" проучвания включват широк спектър от интервенционни проучвания, които не са рандомизирани. Този тип проучване често се използва, когато РСТ не е логистично осъществим или етичен.
Йерархия на доказателствата
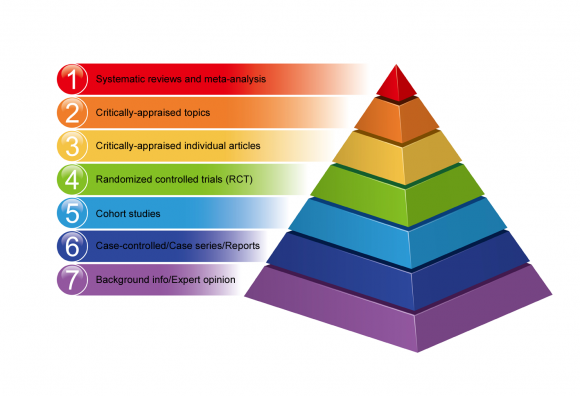
Йерархиите на доказателствата позволяват класирането на различни методи за изследване в зависимост от валидността на техните констатации.
Не всички проекти за научни изследвания са равни по отношение на риска от грешки и пристрастия в техните резултати. Някои методи на изследване предоставят по-добри доказателства, отколкото други.
По-долу е даден пример за йерархията на базираната на доказателства медикамент под формата на пирамида, варираща от по-ниско качество на доказателствата в дъното до висококачествени доказателства на върха.
Фази от клинични изпитвания
Медицинските научни изследвания са разделени на различни етапи, наречени фази. За тестването на наркотици те са определени от FDA.
Проучванията в ранна фаза изследват безопасността на лекарството и страничните му ефекти. По-късни тестове проверяват дали ново лечение е по-добро от съществуващо лечение.
Фаза 0 изпитвания: Фармакодинамика и фармакокинетика
Фаза 0 е проучвателна фаза, която помага за предоставяне на клинична информация за ново лекарство на по-ранен етап.
Тази фаза:
- се провежда в началото на фаза 1
- включва много ограничена човешка експозиция
- няма терапевтична или диагностична намеса, като се ограничава до скрининг и микродоза
Фаза 1 проучвания: Проверка за безопасност
След фаза 0 има още четири фази на изпитвания при хора. Те често се припокриват. Фази от 1 до 3 се извършват преди издаването на лиценз.
Насоките от Фаза 1 включват:
- между 20 и 80 здрави доброволци
- проверка на най-честите странични ефекти на лекарството
- като се установи как се метаболизира и екскретира лекарството
Проучвания във фаза 2: Установяване на ефективност
Ако проучванията във фаза 1 не разкрият неприемливи нива на токсичност, могат да започнат изследвания от фаза 2.
Това включва:
- между 36 и 300 участници
- събирайки предварителни данни за това дали наркотикът работи при хора с определена болест или състояние
- контролирани проучвания за сравняване на тези, които приемат лекарството, с хора в подобна ситуация, които получават различно лекарство или плацебо
- продължителна оценка на безопасността
- проучвания на кратковременни нежелани реакции
Проучвания във фаза 3: Окончателно потвърждение за безопасност и ефективност
Ако фаза 2 потвърди ефективността на даден наркотик, FDA и спонсорите ще обсъдят как да провеждат мащабни проучвания във фаза 3.
Това ще включва:
- между 300 и 3 000 участници
- събиране на допълнителна информация за безопасността и ефективността
- изследвания на различни популации
- изследвайки различни дозировки, за да определите най-добрата сума за предписване
- като се използва лекарството в комбинация с други лекарства за определяне на ефективността
След тази фаза пълната информация за новото лекарство се предоставя на здравните органи.
Преглед на срещата
Ако FDA одобри продукта за маркетинг, се провеждат постмаркетингови изисквания и проучвания за ангажименти.
FDA използва тези проучвания, за да събира допълнителна информация за безопасността, ефикасността или оптималната употреба на продукта.
Ново приложение за наркотици

Спонсор на наркотици ще попълни ново заявление за употреба на наркотици (NDA), за да поиска от FDA да обмисли одобряването на ново лекарство за маркетинг в САЩ
Една НДК включва:
- всички данни за животни и хора
- анализ на данните
- информация относно наркотичното поведение в организма
- подробности за производството
FDA разполага с 60 дни, за да реши дали да го подаде за преглед.
Ако решат да подадат НДК, екипът за преглед на FDA е натоварен да направи оценка на изследванията на спонсора за безопасността и ефективността на лекарството.
След това трябва да се извършат следните стъпки.
Етикетиране на наркотиците: FDA преразглежда професионалното етикетиране на лекарството и потвърждава, че подходящата информация се споделя с потребителите и здравните специалисти.
Инспекция на съоръжението: FDA проверява съоръженията, където ще се произвежда наркотикът.
Одобрение на наркотици: Рецензенти от FDA одобряват заявлението или издават писмо за отговор.
Фаза 4 проучвания: Проучвания по време на продажби
Проучванията във фаза 4 се провеждат след одобрение на лекарството за пускане на пазара. Те са предназначени да включват:
- над 1000 пациенти
- всеобхватен опит в оценяването на безопасността и ефективността на новото лекарство в по-голяма група и субпопулации на пациентите
- сравнение и комбинация с други налични лечения
- оценка на дългосрочните странични ефекти на лекарството
- откриване на по-редки нежелани събития
- рентабилност на лекарствената терапия в сравнение с други традиционни и нови терапии
Доклад за безопасност
След като FDA одобри лекарство, започва постмаркетинговата фаза. Спонсорът, обикновено производителят, представя периодични актуализации за безопасността на FDA.
Кой спонсорира клинични изпитвания?
Клиничните изпитания и изследвания могат да струват стотици милиони долари. Групите, които финансират изпитанията, могат да включват:
- фармацевтични, биотехнологични и медицински изделия
- медицински центрове
- доброволни групи и фондации
- Национални институти по здравеопазване
- държавни ведомства
- лекари и доставчици на здравни услуги
- индивиди
Кой може да участва?
Протоколът определя кой може да участва в съдебен процес.
Възможните критерии за включване могат да бъдат:
- със специфично заболяване или състояние
- като "здрави", без здравословно състояние
Критериите за изключване са факторите, които изключват възможността някои хора да се присъединят към процес.
Примерите включват възраст, пол, специфичен тип или стадий на заболяване, предишна история на лечението и други медицински състояния.
Възможни ползи и рискове
Участието в клиничните изпитвания може да има както ползи, така и рискове за участниците.
Възможните ползи от клиничните изпитвания включват следното:
- Участниците имат достъп до нови лечения.
- Ако лечението се окаже успешно, участниците ще бъдат сред първите, които ще се възползват.
- Участниците, които не са в групата, получаващи ново лечение, могат да получат стандартното лечение за конкретното състояние, което може да е толкова добро, или по-добро от новия подход.
- Здравето се наблюдава отблизо и се подкрепя от екип от здравни специалисти.
- Информацията, събрана от клиничните изпитвания, допълва научните знания, може да помогне на другите и в крайна сметка подобрява здравните грижи.
Възможните рискове включват:
- Стандартната грижа за определено състояние понякога може да бъде по-добра от новата стратегия или лечения, които се изследват.
- Новият подход или лечение може да работи добре за някои участници, но не непременно за други.
- Възможно е да има неочаквани или непредвидени странични ефекти, особено при изпитвания във фаза 1 и фаза 2 и при подходи като генна терапия или нови биологични третирания.
- Здравните осигуровки и доставчиците на здравни услуги не винаги покриват грижите на пациентите и разходите за тези, които участват в клиничните изпитвания.
Какво означава да даваш съгласието си?

Документът с информирано съгласие обяснява рисковете и потенциалните ползи от участието в клинично изпитване.
Елементите, които трябва да се показват в документа, включват, наред с другото:
- цел на изследванията
- предвидими рискове от дискомфорт
- възможни ползи
От участниците се очаква да прочетат подробно документа за съгласие, да решат дали искат да се запишат и да подпишат, преди да могат да бъдат включени в процеса.
Клиничните изпитвания са безопасни ли са?
FDA работи, за да гарантира, че всеки, който възнамерява да се присъедини към процес, има достъп до цялата надеждна информация, от която се нуждаят, за да направи информиран избор, включително информация за рисковете.
Въпреки че рисковете за участниците се контролират и наблюдават, някои рискове могат да бъдат неизбежни поради естеството на медицинските научни изследвания.
Как се защитават участниците?

Безопасността на участниците е въпрос с висок приоритет. Във всяко изпитване научният надзор и правата на пациентите допринасят за тяхната защита.
Добрата клинична практика (GCP) цели да гарантира, че етичните и подходящи процедури се следват в опитите.
Съгласуването с GCP осигурява на обществеността увереност, че безопасността и правата на участниците са защитени.
Тя има за цел:
- за защита на правата, безопасността и благосъстоянието на участниците
- да се гарантира, че събраните данни са надеждни, целостта и качеството на съответната информация
- да предостави насоки и стандарти за провеждането на клинични изследвания
Основите на GCP са заложени за пръв път през 1947 г. Основните моменти са, че по време на всяко изследване изследователите трябва да гарантират:
- доброволно участие
- информирано съгласие
- минимизиране на риска
С течение на времето добавките варират от установяването на допълнителна защита за уязвимите групи от населението до предоставянето на насоки на органи, извършващи изследвания.
Права на пациента
Начините за защита на правата на пациентите включват следното:
Информираното съгласие е процесът на предоставяне на участниците в клиничните изпитвания с всички факти за процеса. Това се случва преди участниците да се съгласят да вземат участие и по време на процеса. Информираното съгласие включва подробности за леченията и тестовете, които могат да бъдат получени, и възможните ползи и рискове.
Други права: документът за информирано съгласие не е договор; участниците могат да се оттеглят от проучването по всяко време, независимо дали изпитването е завършено или не.
Права и закрила на децата: Родителят или настойникът трябва да даде юридическо съгласие, ако детето е навършило 18 години или по-малко. Ако опитът може да включва риск, който е по-голям от минималния, и двамата родители трябва да дадат разрешение. Децата на възраст над 7 години трябва да се съгласят да участват в клинични изпитвания.
Как да намеря клинично изпитване?
Информация за текущите клинични изпитвания можете да намерите тук.